08/10/2020
小児てんかん対抗薬や、カンナビノイド系処方薬の科学、開発、商業化の世界的リーダーであるGWファーマシューティカルズ(GW Pharamceuticals Plc, Nasdaq:GWPH)が、2020年6月30日に終了した第2四半期(Q2)の業績および営業進捗状況を発表した。
GWのCEOであるジャスティン・ゴーバーは、
「COVID-19パンデミックにもかかわらず、第2四半期の米国エピディオレックスの販売が好調であったことに満足しています。 さらに、TSCに伴う発作の治療薬としてエピディオレックスが最近承認され、発売が間近に迫っていることは、2020年後半以降の勢いを加速させることになるでしょう。また、当社の製品パイプライン、特にナビキシモールについては、先日、MSやその他の疾患の患者さんの痙縮の治療薬として米国での開発を加速する戦略を発表しましたが、その可能性にも引き続き期待しています。ナビキシモールの第3相臨床試験をはじめ、複数のパイプラインの臨床試験を下半期に開始できることを楽しみにしています。」
と述べている。
<ハイライト>
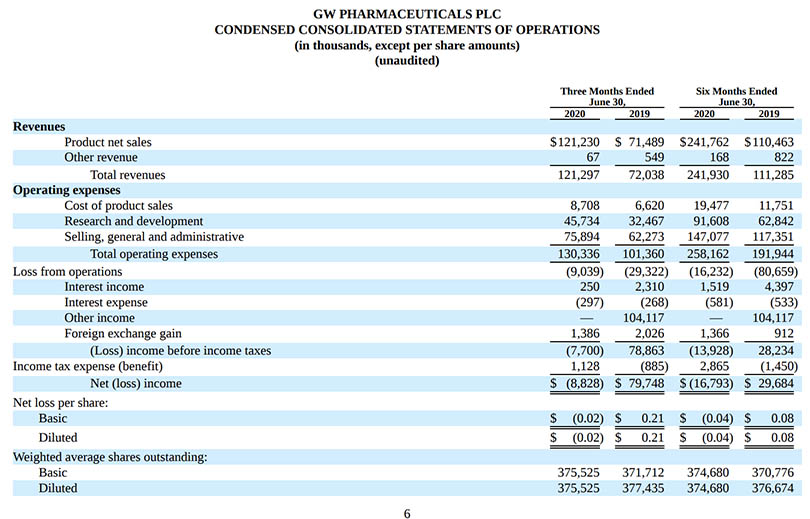
・2020年6月30日に終了した四半期の売上は、2019年6月30日に終了した四半期の79.2億円($72M)に対し、133.4億円($121.3M)だった。
・2019年6月30日に終了した四半期の純利益が87.7億円($79.7M)であったのに対し、2020年6月30日に終了した四半期の純損失は-9.7億円(-$8.8M)。前年同期には、希少小児優先審査バウチャーの売却による純収入114.5億円($104.1M)が含まれている。
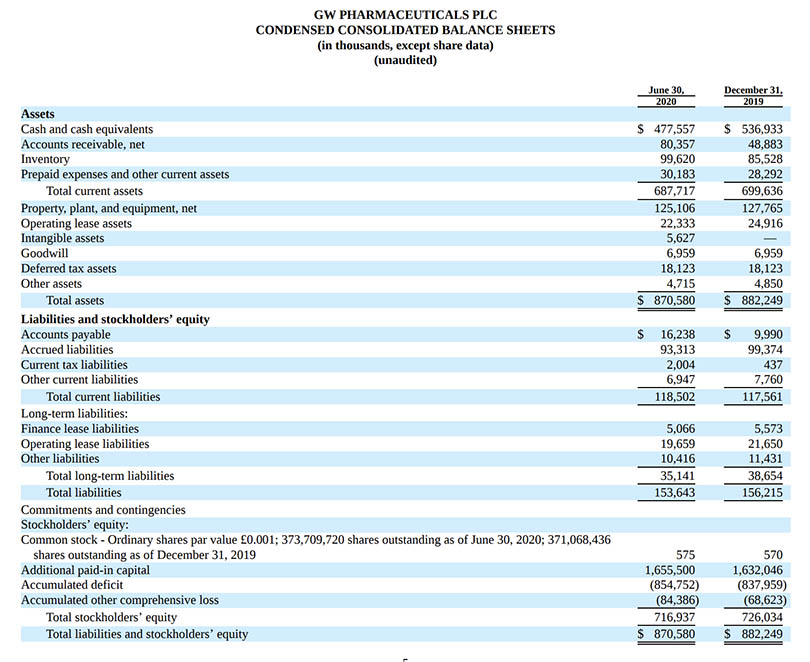
・2020年6月30日現在の現金および現金同等物は525.4億円($477.6M)。
<エピディオレックス市場>
・エピディオレックスの第2四半期の製品売上高合計は129.5億円($117.7M)。
・米国でのエピディオレックスの第2四半期の製品売上高は122.2億円($111.1M)。
・TSCの適応症がFDAに承認され、8月に販売予定。
・TSCの支払者への払い戻しが開始後すぐに予想される。
<ヨーロッパ市場>
・米国製エピディオレックスの第2四半期の純売上高は7.3億円($6.6M)。
・ドイツ、フランス、イタリアでの価格設定と償還の条件調整。
・TSC EMAの提出物は審査中。
<適応症を追加した臨床経過>
・レット症候群を対象とした第3相臨床試験は2020年下半期に再開予定。
<商業的独占性の強化>
・米国とEUにおける希少疾病薬として独占性を確保。
・オレンジブックに新たに3件の特許が登録され、合計13件の特許がオレンジブックに登録され、そのうち12件は2035年に期限が切れる。
・最近記載されている特許には、経口剤形に関する非使用特許がある。
・エピディオレックス組成物特許出願中。
・TSC特許出願審査中。
<ナビキシモール>
・MS痙性臨床プログラム
・米国外では、すでに3つのMS痙性第3相臨床試験が完了している。
・2020年下半期(2)および2021年上半期(3)に、新たに5つのMS痙性第3相試験が開始される予定であり、いずれか1つでもNDA申請が可能となる可能性がある
・第3相筋緊張試験 – プラセボ対照クロスオーバーデザイン
・N=52; Q4 2020開始予定。
・N=190; Q1 2021に開始予定。
・N=36人(ナビキシモルス回答者);開始予定時期は2021年第1四半期。
・第3相スパズム頻度試験-プラセボ対照並行群
・N=450; Q4 2020開始予定。
・N=~200(nabiximols対応者);Q2 2021開始予定。
・脊髄損傷(SCI)痙縮臨床プログラム
・2020年と2021年に3つのSCI試験が開始される見込み。
・N=~100(観察的臨床探索研究)、Q4 2020に開始予定。
・N=~100(ナビキシモール反応者の筋緊張);プラセボ対照並行群設計。Q2 2021に開始予定。
・N=~400(スパズム頻度);プラセボ対照平行群設計。H2 2021に開始予定。
・心的外傷後ストレス障害(PTSD)臨床プログラム
・PTSDを対象としたフェーズ2/3試験(N=~325)H1 2021に開始予定 。
・追加のパイプラインプログラム
・統合失調症(GWP42003)
・第2b相臨床試験は2020年下半期に開始予定。
・自閉症のCBDV試験は2020年下半期に再開の見込み。
・自閉症を対象とした30症例オープンラベル試験。
・自閉症を対象とした研究者主導の100人プラセボ対照試験。
・新生児低酸素虚血性脳症(NHIE)の静脈内CBDプログラム
・患者を対象とした第1b相安全性試験では引き続き募集を実施。
・FDAとEMAから希少疾病用医薬品とファストトラックの指定を受ける。
<<大好評発売中!!>>

「投資に役立つ!よくわかる大麻ビジネス」980円
カンナビストック・ジェーピー編集部 著
「ダメ!絶対!」が浸透している日本では考えられないことだが、アメリカ、カナダ、ヨーロッパで多くの企業がこの産業に参入し、彼らの多くはすでに大麻合法化へと向かう時代の流れを掴み、着々と事業を拡大している。
本書では、大麻ビジネスが世界でどのように展開されているのか、市場規模や各国の状況、そしてどのような産業や企業があるのかをざっと理解できるように構成している。
本書で取り上げた企業はほんの一部に過ぎないが、今後の大麻産業の流れを見る中でも押さえておきたい企業を取り上げた。
本サイトと合わせて読んでいただければ、「グリーンラッシュ」と呼ばれる大麻産業の”今”が理解できるでしょう。


